© EL-Technologie.com 2011
7. Über das Wasser
Die Dipolnatur von Wasser
Die physikalischen und chemischen Eigenschaften des Wassers [1], [2] können im Wesentlichen aus der polaren Natur des
Wassermoleküls erklärt werden, das durch eine kovalente Bindung von zwei Wasserstoffatomen und einem Sauerstoffatom entsteht.
Die Verbindung von zwei Wasserstoffatomen mit einem Sauerstoffatom zu einem Wassermolekül kommt folgendermaßen zustande: Im
atomaren Sauerstoff ist das 1s Orbital vollständig mit zwei Elektronen besetzt, das 2s Orbital ebenfalls, auch eines der drei 2p Orbitale
ist mit zwei Elektronen gefüllt, die beiden anderen 2p Orbitale haben je ein Elektron. Die zwei fehlenden Elektronen können mit je einem
1s Wasserstoffelektron besetzt werden, womit ein sp-Hybridorbital entsteht. Der Sauerstoff ist elektronegativer als der Wasserstoff
(H
stärker zum Sauerstoffkern gezogen, durch diese Symmetriebrechung wird ein elektrischer Dipol mit einer Ladungsverteilung Q+ und Q-
ausgebildet. Der positive Teil der Ladungsverteilung Q+ liegt in dem ursprünglich mit zwei Elektronen voll besetzten p Orbital, der
negative Teil Q- teilt sich auf die beiden anderen p Orbitale auf, die nun miteinander einen Winkel j von etwa 104 Grad einschließen[3]
Unter einem Dipol versteht man eine Ladungsstruktur, die zwei entgegengesetzte Ladungen Q+ und Q- gleicher Größe auf einem
definierten Abstand r besitzt, die aber als Ganzes elektrisch neutral ist. Man charakterisiert einen Dipol durch das Dipolmoment me = Q.
r, dessen Einheit [Coulomb.Meter] = [C.m] beträgt. Die Einheit von 1 Cm ist für molekulare Dipole viel zu groß, weshalb man das
molekulares Dipolmoment in Debye [1 D = 3,3 10-30 Cm] angibt. Der Dipolmomentbetrag des Wassermoleküls beträgt me = 1,85 D, die
Richtung liegt in der Winkelsymmetralen des Winkels, der von den beiden Wasserstoffkernen und dem Sauerstoffkern gebildet wird.
Die meisten Organismen bestehen zum Großteil (70 - 80%) aus Wasser, das jedoch kein träger Füllstoff, sondern eine sehr reaktive
Substanz im intra- sowie interzellulären Bereich ist und den Aufbau biologischer Strukturen, aber auch den Ablauf biologischer Prozesse
entscheidend mitgestaltet.
Diese Reaktivität liegt an den ungewöhnlichen physikalischen und chemischen Eigenschaften des Wassers, die sich alle mehr oder
weniger leicht aus der Dipolstruktur des Wassermoleküls herleiten lassen.
Intermolekulare Wechselwirkungen
Zwischen den einzelnen Molekülen können anziehende Kräfte auftreten, die intermolekular wirken und zu Bindungen von
Molekülkomplexen führen. Diese Kräfte, die im wesentlichen elektrodynamischer Natur sind, fasst man unter dem Terminus »Van-der-
Waals-Kräfte« zusammen, ihre Bindungsenergien sind jedoch geringer als die Energien bei der Molekülbildung. So beträgt
beispielsweise die Stärke der Dipol-Dipol-Wechselwirkung von Wassermolekülen nur etwa 0,2 eV (d. s. 4,5 kcal/mol bzw. 18,8 kJ/mol)
im Vergleich zur 0-H-Bindungsenergie von 4,8 eV (463 kJ/mol) bei. Die Reichweite von Dipol-Dipol-Wechselwirkung ist proportional zu
1/r5, sie ist sehr kurzreichend. Dennoch führt diese intermolekulare Wechselwirkung zweier Wasserdipole zur Bildung von beachtlichen
Molekülkomplexen bzw. Cluster. Beispielweise liegt der Abstand des H-Atoms eines Wassermoleküls vom O-Atom eines anderen
Wassermoleküls im Angströmbereich (10-10 m). Diese Bindung ist jedoch nicht zeitlich konstant, sondern zerfällt nach etwa 10-11 sec[4]
Eine spezielle Art einer Dipol-Dipol-Wechselwirkung ist die Wasserstoffbrückenbindung. Tritt ein H-Atom mit einem elektronegativen
Partner, etwa mit Sauerstoff in Verbindung, so entsteht ein polares Molekül, wobei das H-Atom den positiven Pol desselben bildet.
Dieser Dipol kann ein weiteres polares Molekül anziehen, das dem gebundenen H-Atom seinen negativen Pol zuwendet. Die
Annäherung beider Dipole kann auf sehr kleine Entfernung erfolgen (2,6 - 3,1 .10-10 m), wobei sogar die Van-der-Waals-Radien
unterschritten werden. Das weist darauf hin, dass bei der Bildung dieser Bindung außer der elektrostatischen Wechselwirkung auch
kovalente Beiträge eine Rolle spielen. Bei genügender Annäherung beider Moleküle lässt sich letzten Endes das H-Atom nicht mehr
eindeutig einem der beiden Moleküle zuordnen. Es gehört quasi beiden Molekülen gleichzeitig an und bildet eine Wasserstoffbrücke.
Die Bindungsenergie der Wasserstoffbrücke beträgt etwa 13 bis 25 kJ/mol und ist eine Funktion des Bindungsabstandes. Die H-Brücke
kann aber schon durch thermische Stöße zerstört werden, die im biologischen Temperaturbereich auftreten. Die Bindungsenergie der H-
Brücken ist nicht allein elektrostatisch zu erklären, sondern es müssen, ähnlich wie bei der kovalenten Bindung, quantentheoretische
Aspekte miteinbezogen werden.
Die thermischen Strukturen des Wassers
Die Bildung von Eiskristallen, aber auch von wässrigen Flüssigkeitskristallen im Zustand des thermodynamischen Gleichgewichtes wird
überwiegend durch die Dipolnatur der Wassermoleküle bestimmt. Nimmt die thermische Bewegung der Wassermoleküle ab, so ordnen
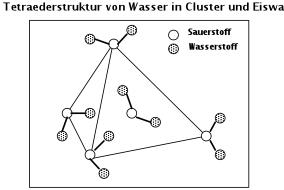
sich die Wasserdipole zu einem fiktiven Tetraeder. Die Bindung der Wasserstoffbrücke H---O ist mit 0,177 nm geringer als die kovalente
Bindung H __ O mit 0,099 nm. Die Fortsetzung der Tetraederstruktur führt zu einem Gitter, das beim Schmelzen des Eises nicht völlig
abgebaut wird und sogenannte Cluster bildet.
Abb.4: Modell der Tetraederstruktur aus Wasserdipolen
Man nimmt an, dass die Zahl der Wasserdipole in der Nähe des Schmelzpunktes zwischen 100 bis 600 und beim in der Nähe des
Siedepunkt zwischen 25 - 75 liegt. Die Wasserstoffbrücken oszillieren als Dipole mit einer Frequenz von 0,5. 1013 Hz. Die
Clusterstrukturen sind aber nicht starr, sondern haben vermutlich nur eine Existenzdauer von 10-10 bis 10-11 s, so dass eine
Wasserstoffbrücke im Mittel 100-1000 mal oszilliert, bis
diese Wasserstoffbrückenbindung aufbricht[5].
Im Unterschied zur Dynamik, deren Systeme meist eine überschaubare Anzahl N von Teilchen enthalten, handelt die Thermodynamik
von einer riesigen Anzahl von Teilchen N. Beispielsweise befinden sich in 1 mol = 18 g flüssigem Wasser H2O (2 x 1 g Wasserstoff plus
1 x 16 g Sauerstoff) NL = 6,022.1023 Wassermoleküle.
Das in der Abb. dargestellte Beispiel von 1 mol = 18 g Wasser enthält NL = 6,022.1023 = 602 200 000 000 000 000 000 000
Wassermoleküle, deren mittlere Geschwindigkeit = 467 m/s bei T = 20 oC und = 495 m/s bei T = 37 oC beträgt.
Abb.5: 1 mol = 18 g Wasser
Wie jeder Stoff kommt auch Wasser in drei Aggregatzuständen vor
als Feststoff, Eis genannt
=> Kristallstruktur
als Flüssigkeit, Wasser genannt
=> Clusterbildung über Wasserstoffbrücken
als Gas, Wasserdampf genannt
=> Einzelmoleküle
Cluster-Strukturen von flüssigem Wasser
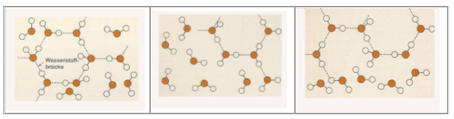
In der Folge sieht man drei Modelle von Wassermolekülen, die die Clusterstruktur des flüssigen Wassers illustrieren. Ständig werden
Wasserstoffbrücken zwischen den verschiedenen Wassermolekülen gebildet und auch wieder gebrochen. Im Durchschnitt bleibt der
Prozentsatz der an den Wasserstoffbrückenbindungen beteiligten H-Atome konstant, doch die einzelnen Bindungen ändern sich ständig.
Nur im gasförmigen Zustand existieren tatsächlich einzelne diskrete Wassermoleküle. Somit sollte die Summenformel des flüssigen
Wassers anstelle von "H2O" wegen der Cluster-Bildung eigentlich lauten: (H2O)n
Abb.6: Modelle von dynamischen Cluster-Strukturen des flüssigen Wassers[6]
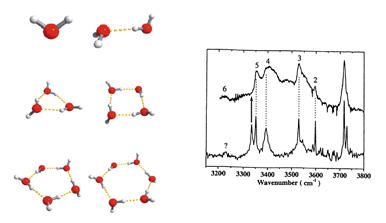
Abb.7: Modellcluster von Wassermolekülen und deren Schwingungs-Wellenzahlen bzw- -Frequenzen
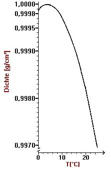
Dichteanomalie des Wassers
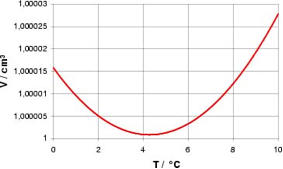
Wasser zeigt bei der Temperatur von T = 4°C seine größte Dichte. Dies ist eine Folge seiner Assoziationsfähigkeit mit
Nachbarmolekülen, die bei T = 4°C die kompaktesten Cluster bilden. Bei Temperaturen größer als 4°C verhält sich Wasser normal, bei
Temperaturen kleiner als 4°C verhält sich Wasser anormal: seine Dichte müsste zunehmen, tatsächlich nimmt sie ab.
Abb. 8 : Volumen und Dichte des Wassers als Funktion der Temperatur
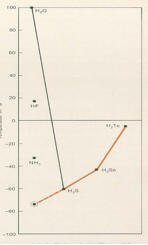
Siedetemperatur des Wassers im Vergleich zu den Verbindungen der 6. Hauptgruppe des Periodensystems
Wasser als Wasserstoffverbindung des Sauerstoffs lässt sich gut mit anderen Wasserstoffverbindungen der Elemente der 6.
Hauptgruppe des PSE vergleichen: während sich die Verbindungen H2S (Schwefelwasserstoff), H2Se (Selenwasserstoff) und H2Te
(Tellurwasserstoff) gemäß der in dieser Reihe zunehmenden Molekülmasse durch steigende Siedetemperaturen erwartungsgemäß
verhalten, macht die Verbindung Wasser eine Ausnahme. Als leichtestes Molekül, das den Stoff "Wasser" aufbaut, sollte Wasser
eigentlich bei etwa T = -75°C sieden !!! Tatsächlich liegt die Siedetemperatur des Wassers bekanntlich bei T = 100 °C. Dies ist nur mit
dem hohen Energieaufwand zu erklären, der zum Aufbrechen des Cluster-Netzwerks aus Wasserstoffbrücken notwendig ist. Gäbe es
diese Erscheinung nicht, müsste Wasser trendgemäß bei der oben angegebenen sehr niedrigen Temperatur sieden. Leben auf dieser
Wasserbasis wäre auf der Erde damit nicht möglich.
Abb. 9 : Siedetemperaturen von Wasser
(Sauerstoffwasserstoff) im Vergleich zu
H2S (Schwefelwasserstoff), H2Se (Selenwasserstoff)
und H2Te (Tellurwasserstoff)[7] <#_ftn7>
Literaturhinweise zu dem Phänomen der Clusterbildung von Wassermolekülen
E. R. Batista,(a) H. Jónsson,(a) and S. S. Xantheas , Multipole Moments of Water Molecules in Clusters and Ice
William R. Wiley Environmental Molecular Sciences Laboratory
Die Dynamisierung von Wasser Teil 3
"In jedem Tropfen Quellwasser sind mehr Kräfte vorhanden, als ein mittleres Kraftwerk der Gegenwart zu erzeugen vermag."
(Viktor Schauberger)